合成致死新靶点——WRN细胞模型
发布时间:2025/11/13分类:技术文章来源:科佰生物
背景
“合成致死”是指两个非致死基因同时被抑制,导致细胞死亡的现象。当两个基因同时失活导致细胞死亡,但任一基因中的单独失活都是无明显毒性。在发生突变失活的肿瘤中,通过抑制其合成致死配对基因,可获得肿瘤选择性杀死。
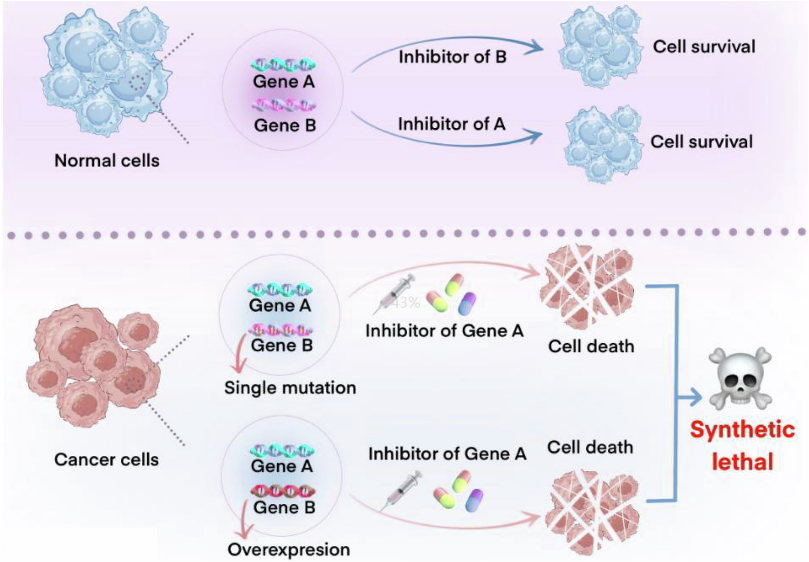
PARP抑制剂是全球首个利用合成致死理论成功研发并在临床实践中取得成功的药物。从2014年首款PARP抑制剂奥拉帕利获FDA批准到现在,已有近10年的时间,但目前尚无针对其他靶点的“合成致死”药物获批。
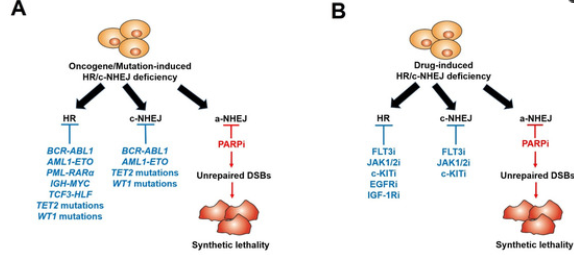
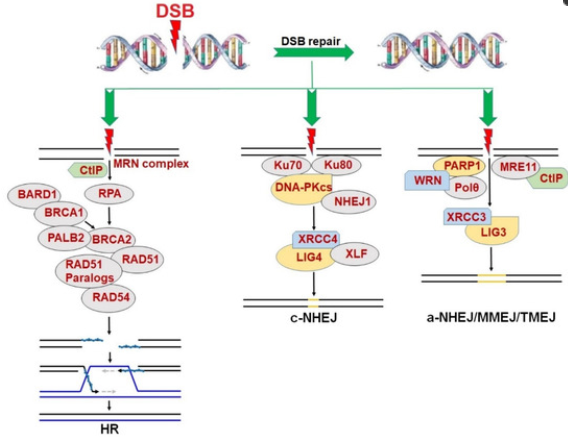
国际顶级期刊之一Nature于去年同一天上线了两篇关于WRN(Werner综合征RecQ解旋酶)抑制剂的文章,其中一篇是关于Novartis的HRO761的发现过程,另一篇介绍了拜耳(Bayer)旗下Vividion Therapeutics 公司的VVD-133214 (又叫RO7589831)的发现过程。这些文章重燃了医药行业对“WRN”这个合成致死靶点的关注。
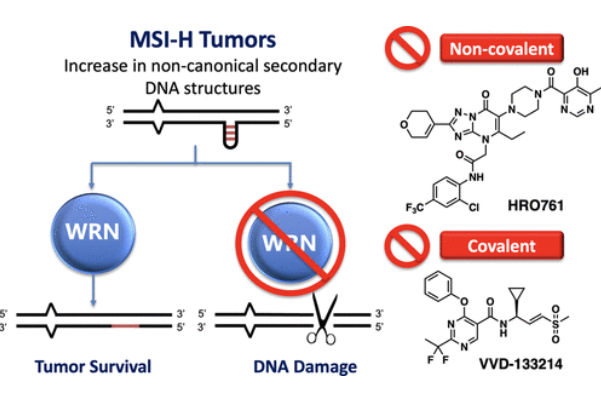
WRN的结构及其功能
WRN(Werner Helicase)是一种具有解旋酶和核酸外切酶活性的多功能酶,在维持基因组稳定性至关重要的各种细胞过程中发挥作用,包括 DNA 复制、转录、DNA 修复和端粒维护。
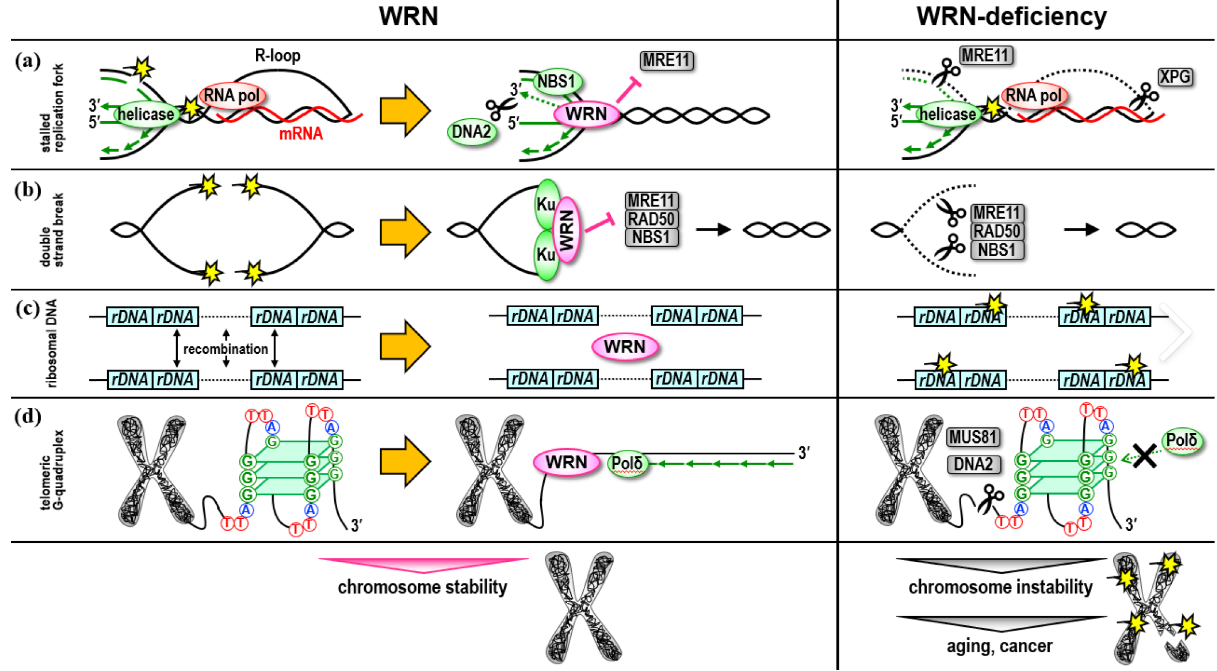
WRN 缺失会导致细胞周期停滞、DNA 损伤、有丝分裂缺陷、染色体破碎和细胞凋亡,特别是在 MSI 细胞中。此外,WRN 敲除减少了移植 MSI(微卫星不稳定性)细胞的小鼠的异种移植物生长和肿瘤形成。引人注目的是,各种 MMR(DNA 错配修复) 成分的急性消耗并没有诱导 MSS(微卫星稳定)细胞对 WRN 的依赖。相反,在MSI细胞中重新引入缺失的MMR成分的基因拯救实验未能拯救合成致死关系。这些实验表明,WRN 合成致死关系是通过 MMR 功能障碍的突变后果而不是通过 MMR 缺陷本身来发展的。此外,使用解旋酶结构域、核酸外切酶结构域或两者内的功能丧失突变对 WRN 的各种酶活性进行剖析,证明 MSI 细胞中的WRN 依赖性仅与其解旋酶功能有关。
WRN的细胞模型
目前全球没有靶向WRN的药物获批上市,进展最快的是开头提到的拜耳旗下公司的VVD-133214和诺华的HRO761。VVD-133214是一款WRN共价变构抑制剂,能够选择性地与WRN上的C727位点结合。诺华的HRO761是一款非共价别构WRN抑制剂,可在D1和D2解旋酶结构域的界面上变构结合,从而将WRN锁定在非活性构象中。HRO761还以剂量依赖的方式诱导WRN降解,激活DNA损伤反应并诱导p53靶基因。
除了以上两款临床阶段的WRN药物外,还有多款处于临床前阶段的靶向WRN的药物,如英矽智能的SM9432A和ISM2196、勤浩医药的GH1581、先声再明的ZM-3329和浦合医药的PH027等等。此外,葛兰素史克(GSK)、Eikon Therapeutics公司、Syros Pharmaceuticals公司和Nimbus Therapeutics公司等也有研究该靶点。
为了助力WRN药物的研发,科佰生物开发了基于基因编辑的WRN细胞模型,用于候选药物早期机理研究。结果如下:
数据展示
WRN[C727A](Heterozygous,AF%:50) Isogenic HCT116 CBP75082
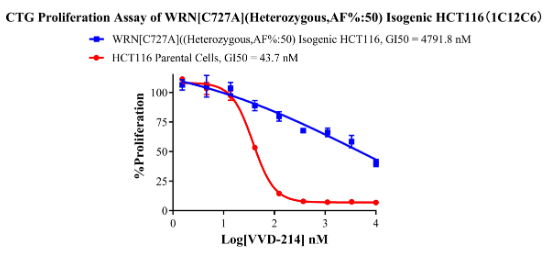
Figure 6. CTG Proliferation Assay of WRN[C727A](Heterozygous,AF%:50) Isogenic HCT116(1C12C6).
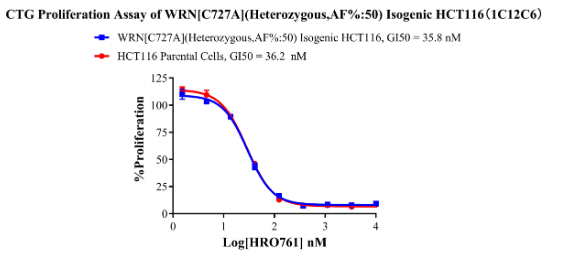
Figure 7. CTC Proliferation Assay of WRN[C727A](Heterozygous,AF%:50) lsogenic HCT116(1C12C6).
WRN[C727A](Homozygous,AF%:100) Isogenic HCT116 CBP75081
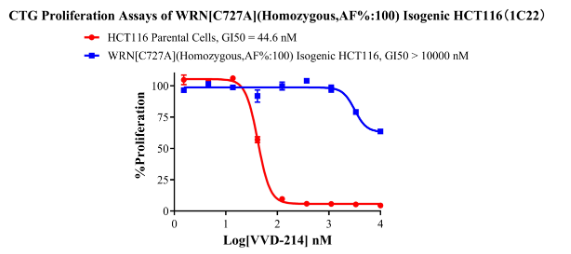
Figure 8. CTG Proliferation Assays of WRN[C727A](Homozygous,AF%:100) Isogenic HCT116(1C22).
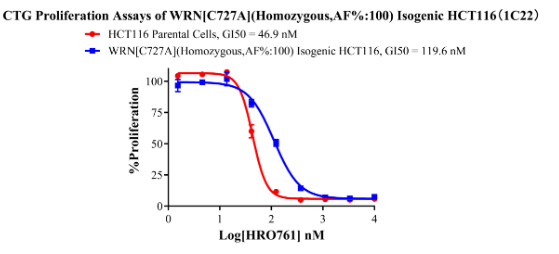
Figure 9. CTG Proliferation Assays of WRN[C727A](Homozygous,AF%:100) Isogenic HCT116(1C22).